近日,动物基因工程与种质创新团队成功构建了人类代谢性炎症猪模型,为人类代谢炎症转化医学研究提供了重要实验材料。相关研究成果发表在免疫学国际知名期刊《免疫学前沿(Frontiers in Immunology)》(IF="7.561)上。
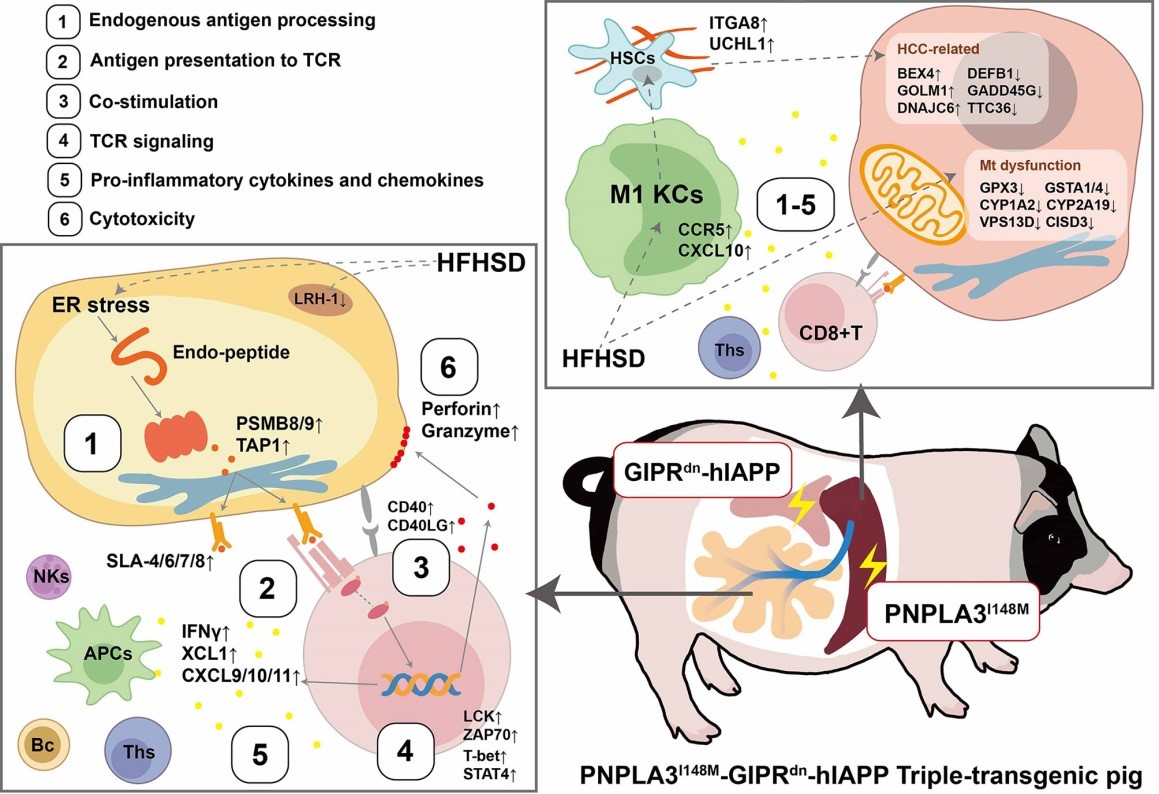
据杨述林研究员介绍,营养过剩引起的慢性、低度炎症是肥胖相关2型糖尿病、非酒精性脂肪性肝病和动脉粥样硬化等代谢性疾病的共同发病基础,由于啮齿类动物与人类之间存在巨大的免疫学差异,相关治疗药物从试验到临床的转化应用效率被限制。研究团队利用多基因定点整合技术,将人类三种代谢性疾病易感基因(GIPRdn、hIAPP和PNPLA3I148M)转入猪基因组,经组织特异性启动子调控抑制胰岛β细胞分化增殖的GIPRdn (葡萄糖依赖性胰岛素释放多肽受体显性抑制突变体)和促进其凋亡的hIAPP (人淀粉样多肽基因)在胰岛β细胞表达,调控人PNPLA3I148M (脂肪滋养蛋白基因I148M突变体)在肝脏中表达。多基因修饰猪表现出葡萄糖耐量受损、脂肪性胰腺、脂肪和肝脏慢性炎症等病理特征,脂肪和肝脏上调表达基因显著富集于代谢性炎症触发及级联反应的CD8+T细胞激活相关通路或生物学过程。通过对在炎症发生过程中发挥关键作用的30个基因蛋白质序列进行同源性比对,发现其中24个基因在猪与人之间的相似性较其在啮齿类与人之间相似性平均高出13%,具有重要免疫调节作用的干扰素γ在猪与人之间的相似性较其在大鼠与人、小鼠与人之间的相似性分别高出24%和22%。上述结果显示,多基因修饰猪脂肪和肝脏代谢炎症触发及级联分子特征与人类高度相似,是临床转化医学研究的适宜材料。
博士研究生张凯艺为该论文第一作者,陶聪副研究员和许建萍主治医师为共同第一作者,北京协和医院肖新化主任、上海交通大学医学院附属新华医院范建高主任和中国农业科学北京畜牧兽医研究所杨述林研究员为共同通讯作者,华中农业大学阮进学副研究员、芬兰赫尔辛基大学夏吉翰博士和比利时列日大学Martine Schroyen教授等人员共同参与了该项研究。
该研究得到了国家自然科学基金、中国农业科学院创新工程和转基因生物新品种培育重大专项等项目的资助。
原文链接:https://www.frontiersin.org/articles/10.3389/fimmu.2021.690069/full










