近日,中国农业科学院北京畜牧兽医研究所奶产品质量与风险评估科技创新团队基于全转录组学分析,建立了赭曲霉毒素A(Ochratoxin A, OTA)损伤小鼠肠道紧密连接蛋白的竞争性内源RNA网络,并揭示了OTA通过WNT/Ca2+信号通路诱导肠道紧密连接蛋白损伤机制,为解析OTA的肠道毒性机制和挖掘其毒性作用靶标提供了重要指导。相关研究成果发表在《生态毒理学与环境安全(Ecotoxicology and Environmental Safety)》上。
肠道紧密连接蛋白可以阻断细胞间隙并阻止细菌和毒素进入血液循环,对维持肠道屏障功能具有重要意义。目前,OTA诱导紧密连接蛋白损伤的相关机制仍不清楚,尤其是缺乏相关的体内研究数据。本研究在转录组学的基础上,利用全转录组学同时分析lncRNA、circRNA、miRNA、mRNA等四种不同RNA的数据,通过miRNA和其他三种RNA的竞争性结合,建立竞争性内源RNA网络,从而实现精准、快速找到关键靶标的目的。
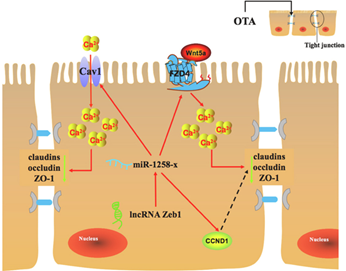
研究人员通过体内动物模型和体外细胞模型验证,结合全转录组学分析,深入研究了OTA损伤肠道紧密连接蛋白的机制。结果表明,OTA通过升高小鼠血清中D-乳酸、肠型脂肪酸结合蛋白的含量,降低绒毛高度与隐窝深度之比、杯状细胞的数量以及紧密连接蛋白的表达水平损伤小鼠肠道屏障功能。全转录组学分析结合体外细胞验证表明,OTA通过WNT/Ca2+信号通路损伤紧密连接蛋白,可能存在的上游机制为:(i)lncRNA-Zeb1通过靶向miR-1258-x调节FZD4与WNT5a结合释放Ca2+;(ii)miRNA-1258-x调节Cav1的表达,控制细胞外Ca2+进入。
该研究得到国家自然科学基金、现代农业产业技术体系、农业科技创新重大成果科研项目和农业科技创新计划项目资助。杨雪为文章第一作者,郑楠为文章通讯作者。
原文链接:https://www.sciencedirect.com/science/article/pii/S0147651321007491?via%3Dihub










